 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free! Get your ComboX free sample to test now!
Get your ComboX free sample to test now!
 Time Limited Offer: Welcome Gift for New Customers !
Time Limited Offer: Welcome Gift for New Customers !  Shipping Price Reduction for EU Regions
Shipping Price Reduction for EU Regions
> Proteínas de la familia del interferón (IFN)

El interferón (IFN) fue descubierto en 1957 por Alick Isaacs y Jean Lindenmann a partir de sus estudios iniciales sobre la interferencia vírica. A lo largo de los años, se realizaron diversos estudios sobre el IFN, en los que se dilucidó su actividad antivírica. No fue hasta 1980 cuando se pudo producir IFN a gran escala para su uso en investigación, donde se utilizó una tecnología pionera de ADN recombinante. Se descubrió que las proteínas IFN tienen funciones antitumorales e inmunomoduladoras junto con su actividad antivírica inherente, lo que las clasifica como un subconjunto de citoquinas.
La familia de proteínas IFN se organiza en tres tipos según su correspondiente receptor: tipo I, tipo II y tipo III; cada uno de los cuales se produce en diferentes localizaciones celulares. El IFN-α y el IFN-β son los miembros más destacados de los IFN de tipo I y son producidos principalmente por patrones moleculares asociados a patogénesis (PAMP). Los PAMP son inducidos por la estimulación de los receptores tipo Toll (TLR) o receptores citoplasmáticos de reconocimiento de patrones localizados en la membrana celular. Los IFN de tipo II son de un solo tipo, los IFN-γ, producidos por diversas células del sistema inmunitario. Esto incluye poblaciones celulares linfoides innatas como los linfocitos innatos (ILC) y las células asesinas naturales (NK), así como células inmunitarias adaptativas formadas por linfocitos T ayudantes 1 (Th1) y linfocitos T citotóxicos CD8 (CTL). Los IFN de tipo III son producidos principalmente por células epiteliales en células no hematopoyéticas, donde los virus pueden mediar la expresión del interferón de tipo III en diferentes tipos de células. Sin embargo, desde que se descubrieron estos IFN en 2003, aún se desconoce el mecanismo exacto de su producción, que es objeto de diversos estudios académicos.
Las vías de señalización correspondientes de los tres tipos de IFN también son diferentes, ya que cada uno se une a diferentes composiciones de complejos receptores heterodiméricos. La señalización intracelular se lleva a cabo a través de la quinasa Janus/transductor de señales y actúa como activador de las vías de transcripción vías (JAK/STAT).
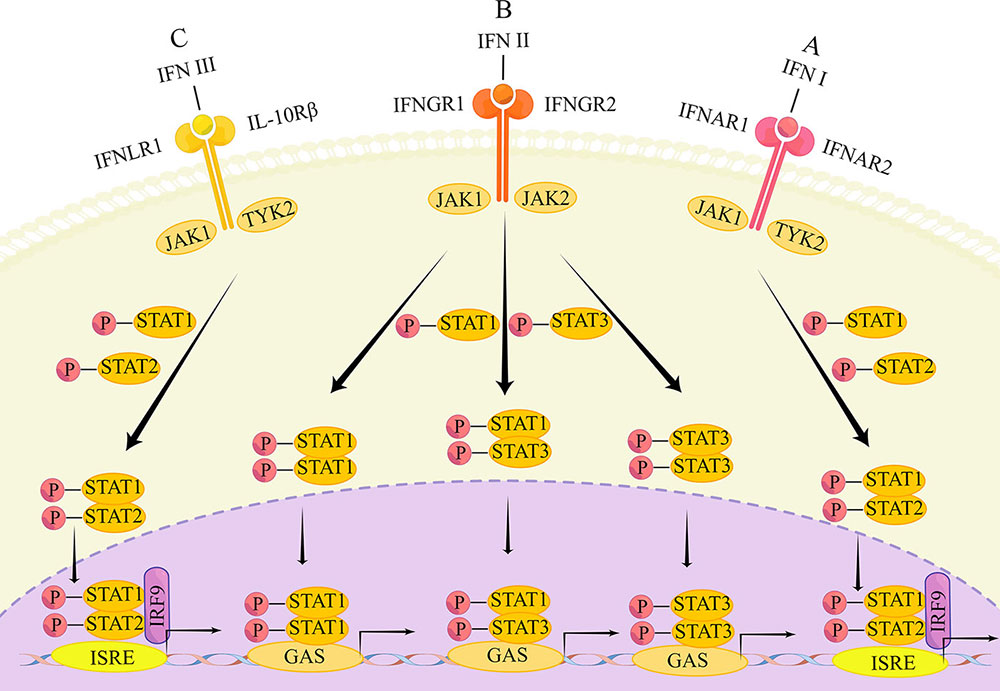
The main transduction pathways of the IFN signaling
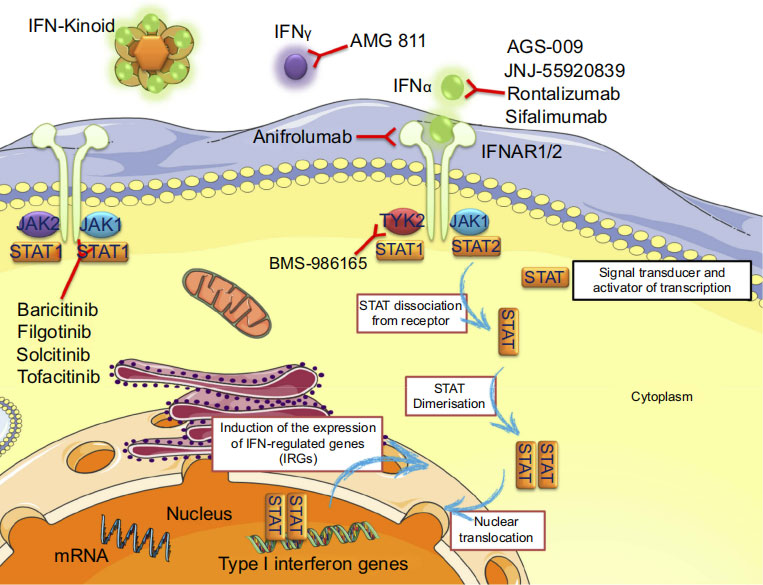
Mechanism of action of a drug targeting IFN (Anifrolumab)
Debido a los amplios efectos de las vías reguladoras del IFN, éste se asocia a menudo con la progresión de enfermedades tumorales. Los estudios in vitro han demostrado que el IFN puede inhibir el crecimiento de células tumorales mediante la regulación al alza del ciclo celular y también inducir la apoptosis mediante la unión a ligandos inductores de la apoptosis relacionados con el factor de necrosis tumoral. Sin embargo, estudios in vivo han demostrado que la supresión de la vía de señalización del interferón tipo I o tipo II acelera la tumorigénesis y la progresión.
La correlación de las respuestas del IFN de tipo I y II con las propiedades oncogénicas lo ha destacado como una vía importante para la resistencia a los fármacos contra el cáncer. Esto se observó a partir de las células tumorales resultantes tras una terapia contra el cáncer que expresaba una señalización de IFN intacta o parcialmente intacta. Como resultado, se desarrolla una resistencia a la replicación viral que impide que la terapéutica dirigida ejerza sus efectos antitumorales normales. Para combatir esto, las terapias dirigidas que inhiben la señalización JAK/STAT por IFN pueden ser una modalidad terapéutica para superar la resistencia a los agentes terapéuticos.
Para ayudarle en su investigación sobre la familia de proteínas IFN, ACROBiosystems ofrece un amplio catálogo de IFN de alta calidad para satisfacer sus necesidades en el descubrimiento de fármacos, la evaluación funcional y el control de calidad.
![]() Expresión HEK293, conformación nativa de la proteína
Expresión HEK293, conformación nativa de la proteína
![]() Alta pureza verificada por SDS-PAGE
Alta pureza verificada por SDS-PAGE
![]() Alta homogeneidad estructural verificada por SEC-MALS
Alta homogeneidad estructural verificada por SEC-MALS
![]() Alta bioactividad verificada por ELISA/SPR/BLI - protocolo disponible
Alta bioactividad verificada por ELISA/SPR/BLI - protocolo disponible
![]() Alta consistencia entre lotes
Alta consistencia entre lotes
| Molecule | Cat. No. | Species | Product Description | Preorder/Order |
|---|
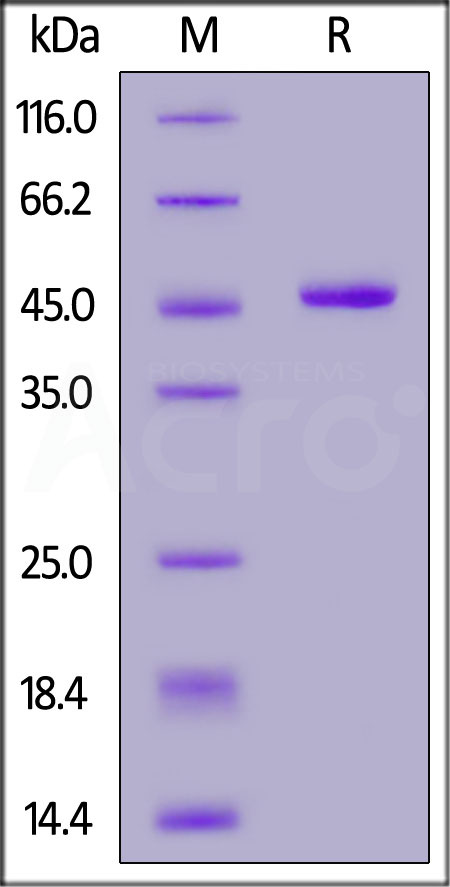
Human IFN-alpha 1 (Cat. No. IFA-H5258), Fc Tag on SDS-PAGE under reducing (R) condition. The gel was stained overnight with Coomassie Blue. The purity of the protein is greater than 95%.
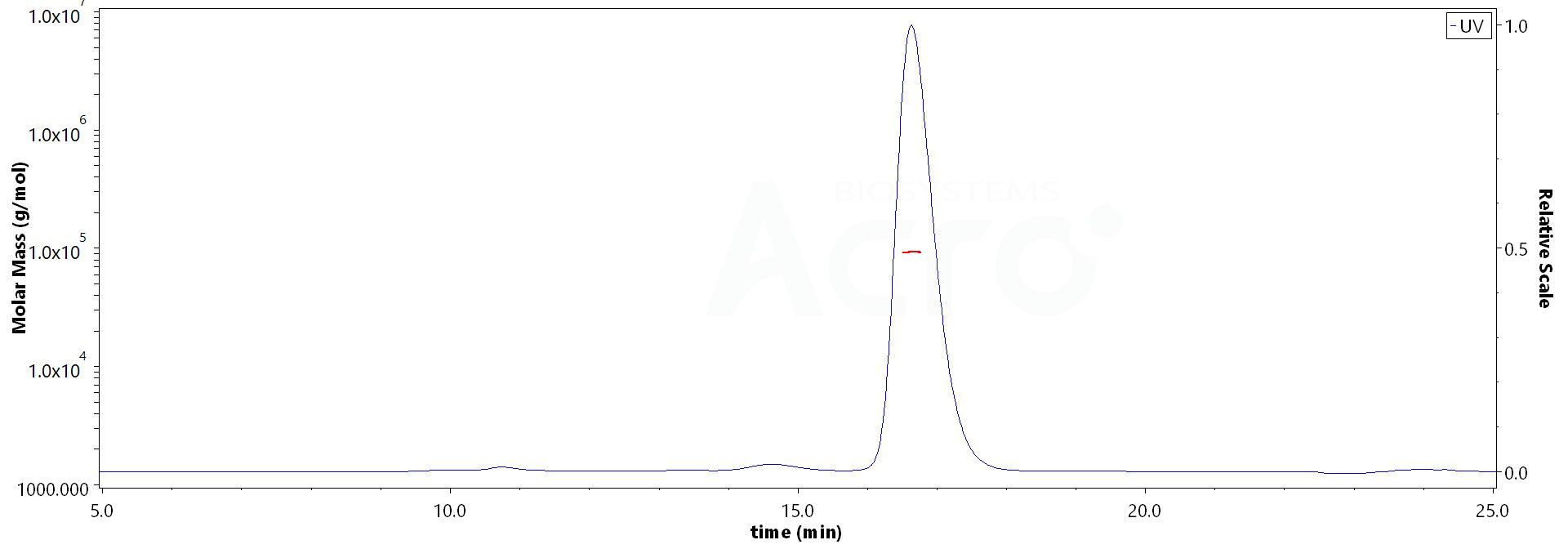
The purity of Human IFN-alpha 1, Fc Tag (Cat. No. IFA-H5258) is more than 90% and the molecular weight of this protein is around 90-118 kDa verified by SEC-MALS.
This web search service is supported by Google Inc.
