 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free! Get your ComboX free sample to test now!
Get your ComboX free sample to test now!
 Time Limited Offer: Welcome Gift for New Customers !
Time Limited Offer: Welcome Gift for New Customers !  Shipping Price Reduction for EU Regions
Shipping Price Reduction for EU Regions
> Proteínas IgG Fc - Control de isotipo ideal para el desarrollo de fármacos estructurados con IgG

Los anticuerpos de inmunoglobulina G (IgG) han atraído una gran atención en la industria farmacéutica debido a su alta especificidad y su superior farmacocinética desde finales de los años 90, especialmente tras la aprobación inaugural del rituximab, el primer fármaco de anticuerpos antitumorales, en 1997. En la actualidad, los anticuerpos IgG se han utilizado con gran éxito en el tratamiento del cáncer y las enfermedades autoinmunes. Las funciones efectoras mediadas por Fc (ADCC, ADCP, CDC) desempeñan un papel importante en los efectos terapéuticos entre los mecanismos por los que varios fármacos de anticuerpos IgG ejercen sus efectos terapéuticos.
Existen cuatro subclases distintas de IgG humana con concentraciones decrecientes, a saber, IgG1, IgG2, IgG3 e IgG4 (aproximadamente 61%, 32%, 4%, 3%). Aunque todas las subclases son idénticas en más de un 90% a nivel de aminoácidos y tienen estructuras espaciales similares. Están muy conservados en cuanto a la longitud de las regiones bisagra, el número de enlaces disulfuro y la función del efecto Fc. Estas regiones están implicadas en la unión a los receptores Ig-FC (FcγR) y C1q. Como resultado, las diferentes subclases tienen diferentes funciones efectoras, tanto en términos de activación de las células que expresan FcγR, lo que resulta en la fagocitosis (ADCP) o la citotoxicidad mediada por células dependientes de anticuerpos (ADCC), como en la activación del complemento (CDC).
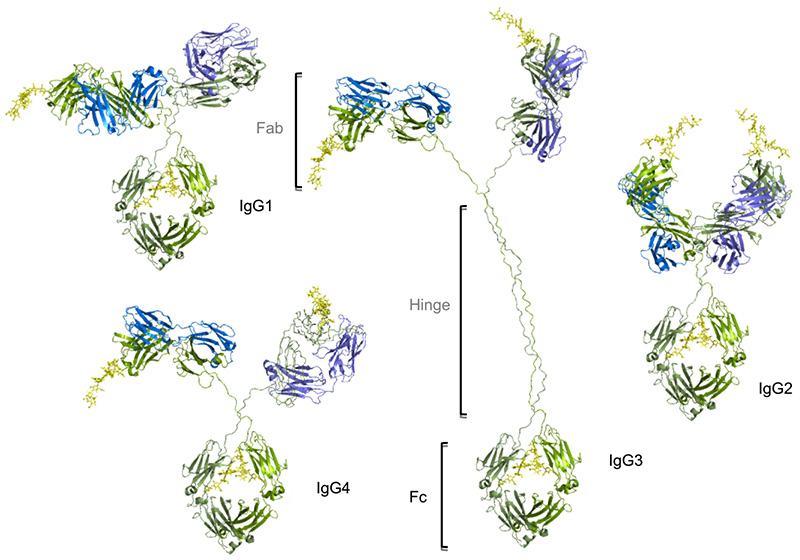
La IgG1 es la subclase con más potencial en la inmunoterapia de los tumores. Además de que la IgG1 humana también puede unirse eficazmente a los Fcγ de ratón, también pueden observarse efectos significativos en modelos in vivo. La vida media de la IgG1 en el organismo es relativamente larga. Además, desde el punto de vista industrial, la IgG1 puede expresarse en gran medida y puede purificarse mediante proteína A, lo que la hace muy económica y estable. Por lo tanto, la IgG1 se ha convertido en el subtipo de IgG más utilizado.
La IgG2 se utiliza principalmente para neutralizar el antígeno o bloquear la unión de los ligandos del receptor. El efecto ADCC es muy débil. Aunque la unión a C1q es relativamente débil, todavía puede desencadenar el efecto CDC cuando la solubilidad del antígeno o anticuerpo es alta. Al mismo tiempo, la IgG2 es el único subtipo que puede unirse a la FcγRIIa (CD32a). En los primeros tiempos, sólo se comercializaban anticuerpos dirigidos al EGFR basados en el subtipo IgG2. Con el aumento de la investigación de los puntos de control inmunitarios, cada vez más fármacos del subtipo IgG2 han entrado en la clínica y están en el mercado.
![]() Expresado por células HEK293: que realizan la glicosilación postraduccional y otras modificaciones y el correcto plegamiento de las proteínas
Expresado por células HEK293: que realizan la glicosilación postraduccional y otras modificaciones y el correcto plegamiento de las proteínas
IgG1 humana Fc, IgG2 Fc, IgG3 Fc, IgG4 Fc | |
IgG1 de ratón Fc, IgG2a Fc, IgG2b Fc | |
Llama IgG2b Fc, Conejo IgG Fc |
![]() Varias etiquetas: Tag Free , Avitag™,His Tag, gD Tag, Flag Tag, Avitag™ & His tag
Varias etiquetas: Tag Free , Avitag™,His Tag, gD Tag, Flag Tag, Avitag™ & His tag
![]() Baja endotoxina:Menos de 1,0 EU/μg por el método LAL.
Baja endotoxina:Menos de 1,0 EU/μg por el método LAL.
más del 95% verificado por SDS-PAGE | |
más del 90% verificado por SEC-MALS |
![]() Alta bioactividad: verificada por ELISA y SPR con protocolos libres
Alta bioactividad: verificada por ELISA y SPR con protocolos libres
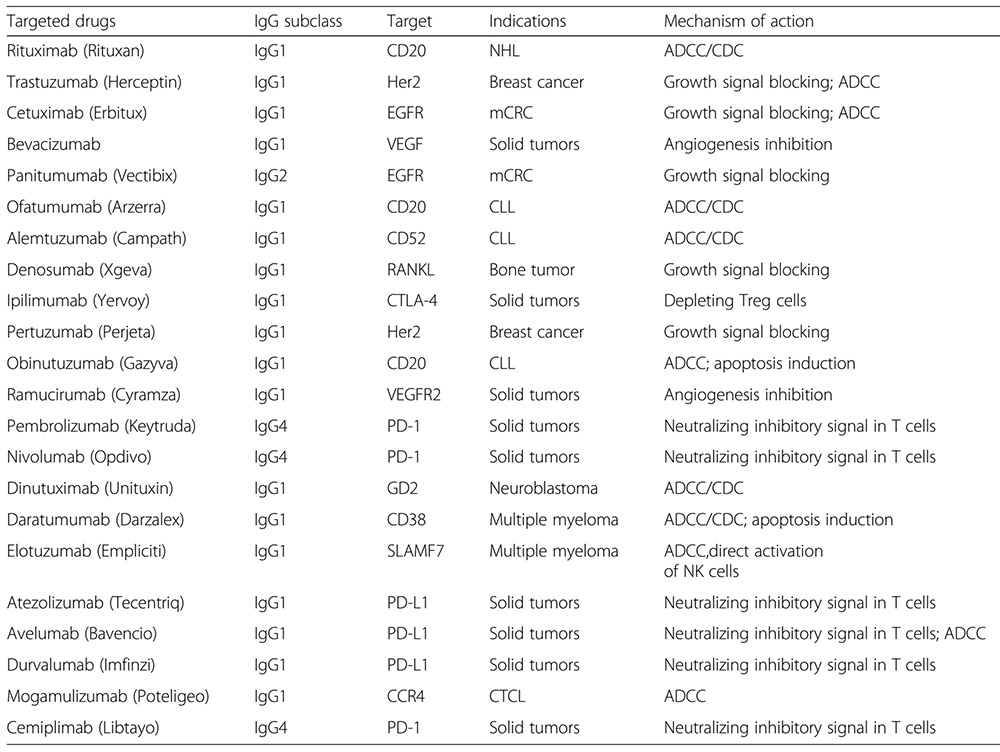
| Molécula | Cat. No. | Especies | Descripción del producto | Prepedido/pedido |
|---|---|---|---|---|
| IgG1 Fc | FCC-H5214 | Human | Human IgG1 Fc Protein, Tag Free (MALS verified) | |
| IgG1 Fc | IG1-H8213 | Human | Biotinylated Human IgG1 Fc protein, Avitag™ (MALS verified) | |
| IgG1 Fc | IG1-H5225 | Human | Human IgG1 Fc Protein, His Tag (MALS verified) | |
| IgG1 Fc | IG1-H52C9 | Human | Human IgG1 Fc Protein, Flag Tag (MALS verified) | |
| IgG1 Fc | IG1-H52G6 | Human | Human IgG1 Fc Protein, gD Tag (MALS verified) | |
| IgG2 Fc | IG2-H5206 | Human | Human IgG2 Fc Protein, Tag Free (MALS & SPR verified) | |
| IgG3 Fc | IG3-H5200 | Human | Human IgG3 Fc Protein, Tag Free (MALS & SPR verified) | |
| IgG4 Fc | IG4-H5205 | Human | Human IgG4 Fc Protein, Tag Free (MALS & SPR verified) | |
| IgG1 Fc | IG1-M5208 | Mouse | Mouse IgG1 Fc Protein, Tag Free (HPLC verified) | |
| IgG1 Fc | IG1-M8211 | Mouse | Biotinylated Mouse IgG1 Fc protein, Avitag™ (MALS verified) | |
| IgG2a Fc | IGA-M5207 | Mouse | Mouse IgG2a Fc Protein, Tag Free (MALS verified) | |
| IgG2a Fc | IGA-M8210 | Mouse | Biotinylated Mouse IgG2a Fc Protein, Avitag™ (MALS verified) | |
| IgG2b Fc | IGB-M5203 | Mouse | Mouse IgG2b Fc Protein, Tag Free (MALS verified) | |
| IgG2b Fc | IGB-L5204 | Llama | Llama IgG2b Fc Protein, Tag Free (MALS verified) | |
| IgG Fc | IGG-R5203 | Rabbit | Rabbit IgG Fc Protein, Tag Free (MALS verified) |
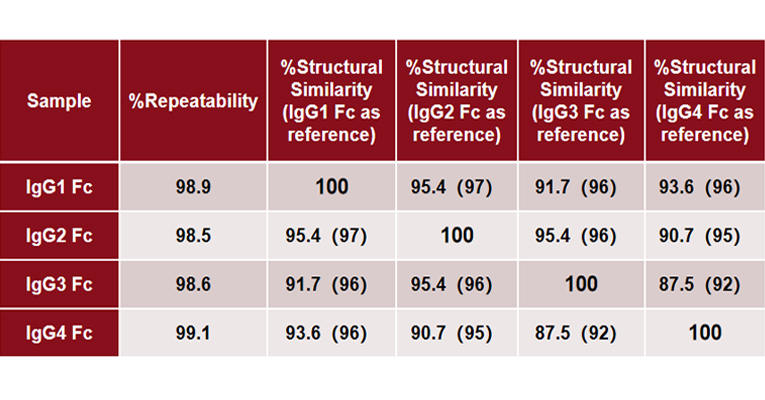
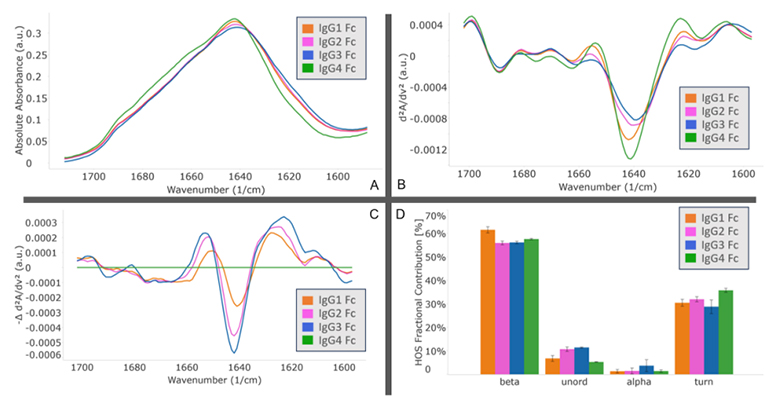
MMS analysis showed that different IgG Fc subclasses exhibit distinct secondary structures. Specifically, IgG1 and IgG2 exhibit the highest degree of structural similarity, while IgG3 and IgG4 show the greatest structural difference.
Explore the In-depth Secondary Structure Analysis of IgG Fc
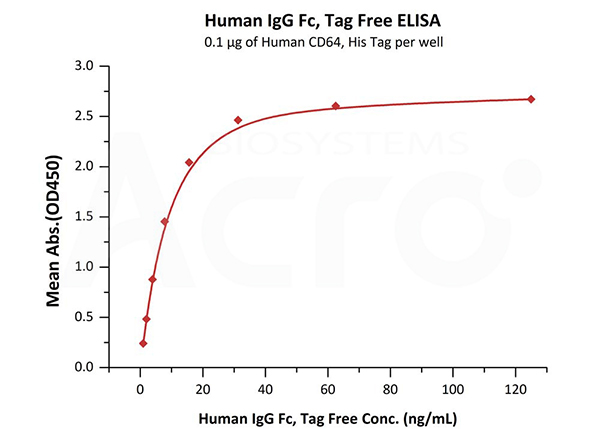
Immobilized Human CD64, His Tag (Cat. No. FCA-H52H1) at 1 μg/mL (100 μL/well) can bind Human IgG Fc, Tag Free (Cat. No. FCC-H5214) with a linear range of 1-16 ng/mL.
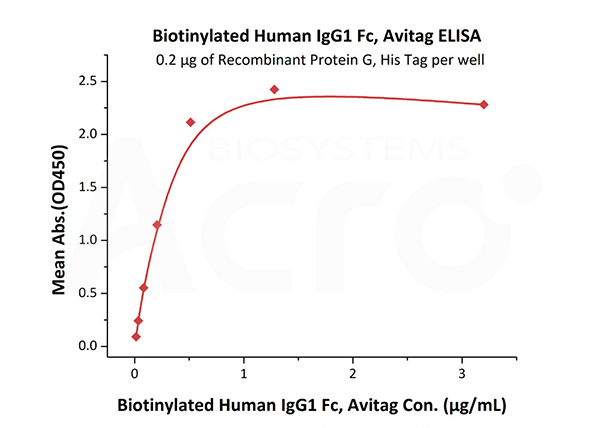
Immobilized Recombinant Protein G, His Tag (Cat. No. RPG-S3140) at 2 μg/mL (100 μL/well) can bind Biotinylated Human IgG1 Fc, Avitag (Cat. No. IG1-H8213) with a linear range of 0.013-0.512 μg/mL.
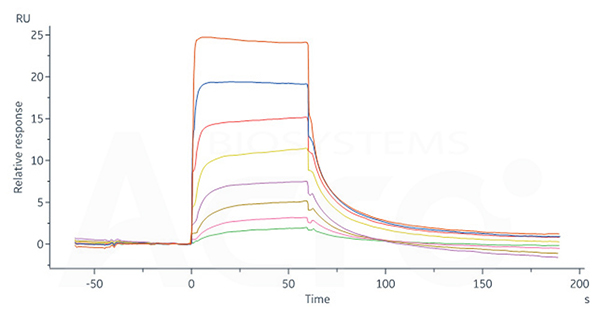
Human FCGRT&B2M Heterodimer Protein, His Tag (Cat. No. FCN-H52W7) captured on CM5 Chip via anti-His antibody can bind Human IgG1 Fc, Tag Free (Cat. No. FCC-H5214) with an affinity constant of 0.957 μM as determined in SPR assay (Biacore 8K).
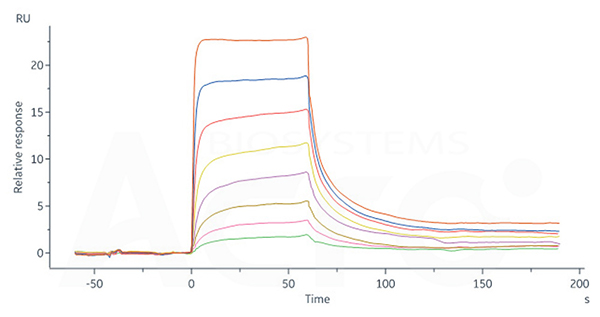
Human FCGRT&B2M Heterodimer Protein, His Tag (Cat. No. FCN-H52W7) captured on CM5 Chip via anti-His antibody can bind Human IgG4 Fc, Tag Free (Cat. No. IG4-H5205) with an affinity constant of 0.715 μM as determined in SPR assay (Biacore 8K).
Mouse IgG2a Fc protein is used as an isotype control to verify the specific binding of Mouse IgG2a CD3 monoclonal antibody (Clone: OKT3) to Human CD3 protein.
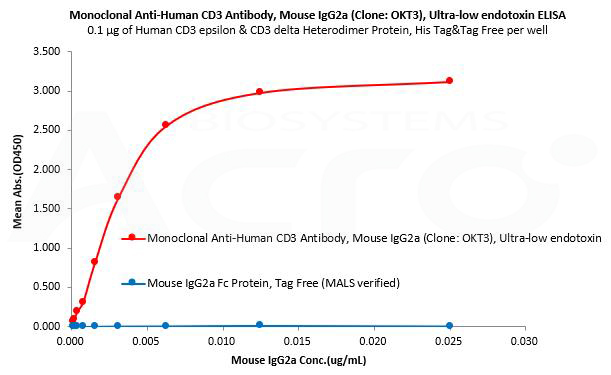
Human CD3 epsilon & CD3 delta Heterodimer Protein, His Tag&Tag Free (MALS verified) (Cat. No. CDD-H52W1) can bind Monoclonal Anti-Human CD3 Antibody, Mouse IgG2a (Clone: OKT3), Ultra-low endotoxin (Cat. No. CDE-M120a) with a linear range of 0.2-3 ng/mL and cannot bind Mouse IgG2a Fc Protein, Tag Free (MALS verified) (Cat. No. IGA-M5207).
La IgG1 Fc humana se utiliza como control de isotipo para verificar la unión específica de anti-BCMA×CD3 scFv- Human IgG1 Fc Tag a la proteína CD3 humana.
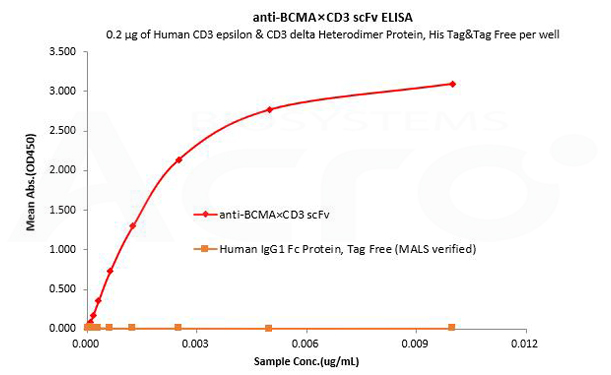
Human CD3 epsilon & CD3 delta Heterodimer Protein, His Tag&Tag Free (MALS verified) (Cat. No. CDD-H52W1) can bind anti-BCMA×CD3 scFv- Human IgG1 Fc Tag with a linear range of 0.08-3 ng/mL and cannot bind Human IgG1 Fc Protein, Tag Free (MALS verified) (Cat. No. FCC-H5214).
La IgG1 Fc humana se utiliza como control de isotipo para verificar la unión específica de anti-BCMA×CD3 scFv- Human IgG1 Fc Tag a la proteína BCMA humana.
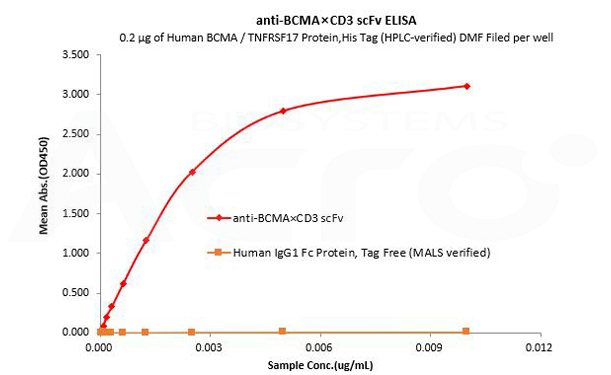
Human BCMA / TNFRSF17 Protein,His Tag (HPLC-verified) DMF Filed (Cat. No. BCA-H522y) can bind anti-BCMA×CD3 scFv- Human IgG1 Fc Tag with a linear range of 0.08-3 ng/mL and cannot bind Human IgG1 Fc Protein, Tag Free (MALS verified) (Cat. No. FCC-H5214).
>>Vida media programable y efectos antitumorales de Nanobody
>>Aumento o disminución: Las dos estrategias terapéuticas a través del mecanismo mediado por el FcRn
Authors:Hayes JM, Wormald MR , Rudd PM, Davey GP
Authors:Yu et al.
Authors:Ditza Levin et al.
This web search service is supported by Google Inc.
